Autore
Dott.ssa Giovanna Mosaico
Parole chiave
Microbiota della lingua, simbiosi ospite-microbiota, diagnosi della lingua, correlazioni sistemiche, mininvasività.
Keywork
Tongue microbiota, host-microbiota symbiosis, tongue diagnosis, systemic correlations, minimally invasive.
Abstract
La lingua è in grado di riflettere rapidamente lo stato di salute o di malattia del corpo umano. La sua ispezione è un importante approccio diagnostico, è un metodo unico che permette di esplorare la patogenesi delle malattie basandosi sui principi guida del concetto olistico che prevede l’osservazione dei cambiamenti nel rivestimento della lingua al fine di comprendere le funzioni fisiologiche e i cambiamenti patologici dell’organismo. Può essere considerato un potenziale metodo di screening e diagnosi precoce del cancro. Tuttavia l’ispezione soggettiva della lingua ha un basso indice di affidabilità, pertanto sono stati sviluppati dei sistemi computerizzati di acquisizione delle bioinformazioni diagnostiche per analizzare il rivestimento della lingua. La tecnologia di sequenziamento di nuova generazione è utilizzata per determinare le regioni ipervariabili V2-V4 dell’rRNA 16S per studiare il microbiota. Molti tumori sono diagnosticati in fase avanzata, principalmente perché la maggior parte dei pazienti è asintomatica nella fase iniziale. Diagnosticare nello stadio iniziale potrebbe aumentare il numero di tumori curabili e migliorare la sopravvivenza. Evidentemente, è necessario sviluppare nuove strategie in medicina orale per la diagnosi precoce delle malattie e la diagnosi della lingua come metodo mininvasivo è sicuramente una di queste.
Introduzione
Per migliaia di anni, i medici hanno diagnosticato lo stato di salute di un paziente ispezionando la lingua, in particolare il dorso della lingua. Osservare i cambiamenti nel rivestimento della lingua per intercettare disturbi sistemici che coinvolgono gli organi interni come metodo di diagnosi clinica è una caratteristica unica della medicina tradizionale cinese (TCM) (1,2) Secondo la teoria della TCM: “Una malattia deve avvenire con una manifestazione del rivestimento della lingua”. Il rivestimento è la manifestazione esterna, saldamente corrispondente alla malattia interna, è il primo indizio per i medici per fare una diagnosi: questo non può essere trascurato (3) pertanto, esplorare le basi molecolari della diagnosi della lingua è fondamentale per comprendere questa pratica medica di lunga data (1,3,4).
Diversi studi hanno completato l’analisi microbica della lingua umana sana, attraverso il sequenziamento dell’rRNA 16S, dimostrando che i phyla più abbondanti sono Fusobatteri, Actinobacteria, Firmicutes, Proteobacteria e Bacteroidetes (1,4,5).
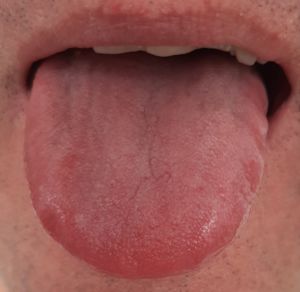
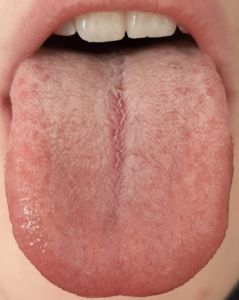
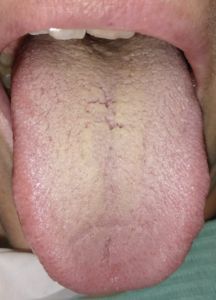
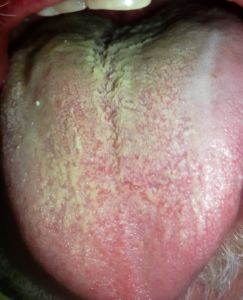
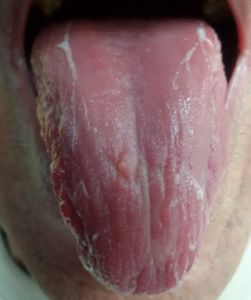
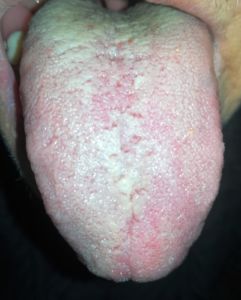
La variazione del microbiota del rivestimento della lingua registrata mediante sequenziamento metagenomico, identifica i potenziali biomarcatori per diverse patologie inclusa la cascata precancerosa (1,7). Il rivestimento linguale con patina sottile è un simbolo di buona salute (fig n.1 e n.2) mentre il rivestimento “bianco-grasso” e “giallo-denso” (fig. 3,4) può essere indicazione di infiammazione, infezione e stress, nonché disturbi immunitari ed endocrini (fig 5), (8,9). Il rivestimento spesso e l’umidità della lingua sono aumentati nei tumori. Sono state esplorate le relazioni tra diagnosi della lingua e malattie tra cui l’artrite reumatoide, la gastrite e le lesioni precancerose, il cancro epatico, del pancreas e del polmone (1,10-15).
I biomarcatori del microbiota del rivestimento della lingua potrebbero fornire un complemento per la diagnosi di diverse malattie con la possibilità di poterle monitorare nel tempo (1,16). La diagnosi della lingua è un metodo semplice e non invasivo per valutare le condizioni fisiologiche osservando lo spessore e il colore del rivestimento (7). Il mantello della lingua è classificato in tre categorie in base a diversi tipi di colore, vale a dire, rivestimento della lingua bianco (W), rivestimento della lingua giallo (Y) e rivestimento della lingua nero e grigio (tab. n.1). Un rivestimento Y è considerato un segno di ritenzione idrica e calore (3). Quattro sono le sindromi più comuni che sono identificate rispettivamente come: la sindrome del freddo esterno, la sindrome del freddo interno, la sindrome del calore esterno e la sindrome del calore interno. Ogni sindrome è associata al rivestimento della lingua bianco sottile, bianco spesso, giallo sottile e giallo spesso (1). Le sindromi fredde e calde sono due condizioni contrarie, ma correlate all’interno del corpo umano(8). Secondo la teoria TCM, la lingua è un’estensione esterna della milza e dello stomaco (18). La medicina occidentale fa riferimento agli indici dello spessore del mantello sul dorso della lingua classificandola in 4 gradi (19)(tab. n:2).
Tab. n.1: classificazione della patina linguale secondo lo standard della TCM
| Descrizione |
| Rivestimento della lingua bianco sottile, bianco spesso e bianco grasso |
| Rivestimento della lingua giallo sottile, giallo spesso e giallo grasso |
| Rivestimento della lingua nero e grigio sottile e nero grigio spesso |
Tab. n.2: classificazione della patina linguale secondo lo standard di Miyazaki
| Valore | Descrizione |
| 0 | Assenza di patina visibile sul dorso della lingua |
| 1 | Patina presente solo al III posteriore della lingua |
| 2 | Patina che ricopre completamente la superficie dorsale della lingua ma non maschera la mucosa sottostante |
| 3 | Patina che ricopre tutta la superficie dorsale della lingua di elevato spessore |
Diversi studi hanno mostrato che la Lautropia era significativamente aumentata nella gengivite, nel lichen planus orale e nella parodontite cronica (20,21,22,23,24). Il livello di Capnocytophaga era significativamente più alto nella saliva dei pazienti con cancro orale (25,26). Questi risultati hanno indicato che il rivestimento della lingua almeno il rivestimento sottile W è un importante riferimento del microbiota orale. Per quanto riguarda i 9 taxa aumentati nel rivestimento spesso W, Megasphaera salivare è stato osservato più abbondante nei pazienti con carcinoma polmonare (5), Selenomonas fecale era significativamente aumentato nei pazienti con carcinoma del colon e i dati hanno indicato che il rivestimento spesso W possa essere correlato al rischio di tumori secondo il microbioma intestinale (27,28). Prevotella era stata implicata con infezione parodontale (29); Prevotella maculosa perimplantare era aumentata nei pazienti fumatori affetti da mucosite ma diminuita nei pazienti non fumatori. Questi dati hanno indicano che il rivestimento spesso W è strettamente correlato alle malattie parodontali (30). Per quanto riguarda il rivestimento della lingua gialla, sono stati osservati pochi potenziali microbioti in particolare batteri opportunisti (20).
I ricercatori hanno dimostrato che il microbiota orale è associato a molte malattie, come le malattie del pancreas, la malattia infiammatoria intestinale pediatrica, l’obesità, la malattia coronarica, l’artrite reumatoide, il cancro gastrointestinale, la cirrosi epatica, le malattie cardiovascolari e la polmonite. È stato anche riferito che la relazione tra il microbiota del rivestimento della lingua e la diagnosi era rilevante per la differenziazione della malattia (3,9,10,16,17).
La cavità orale è uno dei più grandi serbatoi batterici nel corpo umano e numerosi batteri coesistenti costruiscono una comunità complessa e stabile. È noto che gli Streptococchi mutans e il complesso rosso, che comprende Porphyromonas gingivalis, Tannerella forsythya e Treponema denticola, sono i batteri più importanti associati alla carie dentale e alla malattia parodontale, che sono le principali malattie orali (6,31,32). Inoltre, negli ultimi anni è stata segnalata l’esistenza di specifiche specie batteriche orali correlate a malattie sistemiche (33), per questo la disbiosi orale ha attirato l’attenzione come eziologia delle malattie orali e sistemiche (34).
Dopo la nascita, la cavità orale dei neonati è esposta a una grande varietà di microbi e il microbiota orale si sviluppa man mano che i neonati crescono. Si pensa che i batteri anaerobi facoltativi come lo Streptococco e gli Actinomiceti siano colonizzatori pionieri nella cavità orale di un neonato; in particolare, si ritiene che lo Streptococcus salivarius sia il colonizzatore pioniere predominante (35). Sebbene il phylum Firmicutes predomina sia nel microbiota orale che nell’intestino, il genere Streptococcus all’interno del phylum Firmicutes viene raramente rilevato nel microbiota intestinale (36) pertanto, la predominanza delle specie di Streptococcus è caratteristica del primo passo nella formazione del microbiota orale. È stato anche riferito che la formazione del microbiota indigeno orale inizia entro le prime 6 settimane di vita e lo streptococco domina rapidamente la cavità orale durante questa fase (37). La composizione batterica della lingua nella fase di transizione, da 80 a 120 settimane diviene sempre più simile a quella degli adulti. Le colonie corrispondenti a Streptococcus peroris e Streptococcus lactarius sono diminuite esponenzialmente immediatamente dopo 30 e 49 settimane, mentre Granulicatella adiacens, Actinomyces odontolyticus e Fusobacterium periodonticum sono aumentate reciprocamente nello stesso periodo (38). Un drastico spostamento compositivo del microbiota della lingua si verifica prima dell’età di 1 anno, quindi la diversità e la composizione batterica complessiva raggiungono livelli comparabili a quelli degli adulti entro i 2 anni(6).
Il dorso della lingua ha una grande superficie con strutture papillari (39) che può trattenere numerosi microrganismi, inclusi sia gli aerobi che gli anaerobi (40). Il rivestimento della lingua è costituito da batteri, funghi, metaboliti nel sangue, saliva ed epitelio cheratinizzato esfoliato (desquamato) originato da papille filiformi. Le papille filiformi sono una struttura specifica che comprende la formazione del rivestimento della lingua, questa struttura è composta da molte crepe e pieghe che aumentano la superficie della lingua e l’ambiente caldo, umido e nutriente fornendo un terreno adatto per la colonizzazione, la crescita e la proliferazione dei microrganismi (41,42). Il biofilm orale ospita uno dei siti più microbiologicamente diversificato e la mucosa della lingua accumula un numero maggiore di microbiomi rispetto ad altre parti della cavità orale, il che rende il rivestimento della lingua un micro-ecosistema relativamente completo e indipendente. La comunità microbica è meno aggregata rispetto alla placca dentale, consentendo alle cellule batteriche di accedere rapidamente a nutrienti sufficienti tramite la saliva (43). La struttura libera della comunità e la desquamazione delle cellule epiteliali facilitano il rilascio di microrganismi residenti nella saliva (44). Queste caratteristiche implicano che si dovrebbe prestare più attenzione al microbiota della lingua negli anziani con problemi di deglutizione (45). Inoltre, un aumento dello spessore del rivestimento della lingua negli anziani edentuli, è stato associato con polmonite da aspirazione e stato febbrile (46,47). La cavità orale umana è densamente colonizzata da diversi microrganismi sulle superfici intraorali che vengono costantemente versati nella saliva, normalmente, i batteri ingeriti con la saliva sono trasportati attraverso l’esofago nello stomaco e vengono quindi disattivati dall’acido gastrico e dagli enzimi proteolitici. Tuttavia, la disfagia e il reflusso gastrico ne favoriscono l’aspirazione nel tratto respiratorio inferiore con conseguente infezione polmonare (48). I disturbi della deglutizione sono molto diffusi nei pazienti anziani con polmonite, che è una delle principali cause di morte durante questa fase della vita. Gli anziani con meno denti, scarsa igiene orale e più carie dentale sperimentano costantemente una disbiosi, con una maggiore abbondanza relativa di specie Prevotella, Veillonella e Streptococcus e un numero maggiore di specie fungine. Si presume quindi che la disbiosi del microbiota del rivestimento della lingua si verifichi con una frequenza più elevata nelle persone anziane. Si dovrebbe prestare particolare attenzione allo stato della lingua mettendo in atto corrette abitudini di igiene orale con particolare attenzione al dorso della lingua. Nello specifico l’igiene orale meccanica per abbassare il carico microbico orale è riconosciuta quale approccio efficace per ridurre il tasso di mortalità per polmonite da aspirazione tanto che in alcuni sistemi sanitari viene garantita come assistenza standard la figura professionale degli igienisti dentali per la cura dell’igiene orale nelle persone anziane fragili negli ambienti ospedalieri e delle case di cura (49). Sebbene la saliva aspirata contenga microrganismi che colonizzano vari siti orali, la loro composizione batterica indica che la fonte dominante è il microbiota formato sulla lingua (50,51).
Alcuni studi hanno dimostrato che la malattia parodontale, causata da batteri parodontali come Porphyromonas gingivalis, Tannerella forsythya e Treponema denticola, è un fattore di rischio per una varietà di malattie, come la malattia vascolare aterosclerotica, il diabete di tipo 2 e malattia del fegato grasso non alcolica (fig n.6) (52,53,54). Poiché ingeriamo con la saliva innumerevoli batteri orali, è ragionevole sospettare che alcuni di essi inducano disturbi del microbiota intestinale (55). Altri studi hanno riferito che l’ingestione orale ripetuta di P. gingivalis favorisce un’infiammazione sistemica. Queste prove hanno anche indicato l’importanza del microbiota orale come induttore o potenziatore per diverse malattie sistemiche (56).
Diversi studi hanno utilizzato colture di batteri, esame microscopico ed elettroforesi denaturante con gradiente in gel per studiare la relazione tra il rivestimento della lingua e il microbiota nella pancreatite acuta, nella sindrome dell’intestino irritabile e nel cancro polmonare, mentre sempre più ricercatori hanno iniziato a utilizzare la tecnologia di sequenziamento di nuova generazione per descrivere in modo completo il microbiota del rivestimento della lingua (1). Un numero crescente di prove ha dimostrato che il microbiota potrebbe influenzare la proliferazione delle cellule tumorali (57). L’opinione attuale è che le risposte proinfiammatorie causate dai microbi possono essere procarcinogene, tuttavia i metaboliti microbici possono contribuire al tono infiammatorio e influenzare l’equilibrio della proliferazione e la morte cellulare nei tessuti. Dieci microbi specifici sono stati designati come agenti patogeni cancerogeni dall’agenzia internazionale per la ricerca sul cancro (IACR). Di questi, Helicobacter pylori è il microrganismo più conosciuto ed è considerato il maggiore responsabile nello sviluppo del carcinoma gastrico (58). Il GC è promosso dalla presenza di uno speciale microbiota con l’aumento del pH, di conseguenza l’ambiente specifico dello stomaco ha modellato le composizioni del microbiota gastrico e successivamente ha aumentato la conversione batterica dei nitrati alimentari in agenti cancerogeni (59). Nei pazienti con GC, il microbiota gastrico era predominato da Veillonella, Emofili insieme a Streptococchi, Lactobacillus, Prevotella e Neisseria. È stato notato che alcuni dei batteri (Veillonella, Streptococchi, Lactobacillus) sono stati osservati anche nella comunità microbica della lingua (60). Questo risultato ha indicato che anche il microbiota del rivestimento della lingua è strettamente correlato alla diagnosi del GC. La disbiosi del microbiota salivare è associata anche risposte infiammatorie nei pazienti con colite ulcerosa (61).
- Lingua rossastra simbolo di salute con mantello sottile (TCM), grado 0/1 secondo Miyazaki
- Lingua bianca sottile (TCM), grado 2 secondo Miyazaki
- Lingua bianca e gialla spessa (TCM) grado 3 secondo Miyazaki
- Lingua gialla grassa (TCM) grado 2 secondo Miyazaki
- Mantello desquamato della lingua correlato a grave ipovitaminosi
- Mantello spesso bianco grasso della lingua correlato a diabete di tipo 2 , ipertensione e malattia del fegato grasso non alcolica
Scopo
Lo scopo di questa minirevisione della letteratura è esplorare il microbiota del rivestimento della lingua ed indagare sui metodi di studio per lo screening e la diagnosi precoce di particolari malattie sistemiche in medicina orale.
Materiali e metodi
Sono stati analizzati articoli scientifici disponibili sui principali database del campo medico – PubMed, Gogle scolar, Scopus – per i quali sono stati delineati criteri di inclusione e criteri di esclusione.
Più nel dettaglio, i criteri di inclusione comprendevano:
- Articoli scientifici pubblicati senza limite di tempo
- Articoli internazionali in lingua inglese
- Poster, paper, pilot
- Studi sperimentali senza limiti di età
- Studi sperimentali in vivo e studi sperimentali in vitro
- Expert review (solo consultazione)
- Revisioni della letteratura (solo consultazione)
- Revisioni narrative (solo consultazione)
- Revisioni storiche e milestone papers (solo consultazione)
I Criteri di esclusione comprendevano
- Articoli scientifici che trattavano in maniera più generica il microbiota del cavo orale
Risultati
Inserendo le keywords in inglese “Tongue microbiota”(174 risultati) e “Tongue microbiota and disease” (76 risultati), dopo l’identificazione preliminare di 250 articoli, gli articoli sono stati esaminati al fine di valutare i criteri di inclusione, 77 sono stati considerati conformi ai criteri di inclusione.
Diversi studi hanno dimostrato che i phyla più abbondanti sono Fusobatteri, Actinobacteria, Firmicutes, Proteobacteria e Bacteroidetes.
Lo Streptococcus salivarius era il colonizzatore pioniere predominante del cavo orale nel neonato mentre lo S. mutans era presente esclusivamente nel cavo orale. In due studi il livello di Capnocytophaga era significativamente più alto nella saliva dei pazienti con cancro orale. Il Megasphaera salivare era stato osservato più abbondante nei pazienti con carcinoma polmonare, mentre Selenomonas fecale era significativamente aumentato nei pazienti con carcinoma del colon e Prevotella era stato implicato con infezione parodontale. Prevotella maculosa perimplantare era aumentata nei pazienti affetti da mucosite da fumo ma diminuita nei pazienti affetti da mucosite nei non fumatori. Prevotella, Haemophilus e Streptococcus erano aumentati nel microbioma della lingua in pazienti con carcinoma del colon-retto. Il Porphyromonas gingivalis era coinvolto nell’iniziazione e nella progressione dell’ artrite reumatoide. Alcuni studi hanno dimostrato che la malattia parodontale, causata da batteri come il Porphyromonas gingivalis, Tannerella forsythya e Treponema denticola, era un fattore di rischio per una varietà di malattie, come la malattia vascolare aterosclerotica, il diabete di tipo 2 e la malattia del fegato grasso non alcolica. Tra 506 adulti di età compresa tra 70 e 80 anni vi era predominaza di S. salivarius nel microbiota della lingua, vi erano inoltre due gruppi di convivenza competitivi nel microbiota e il rapporto di questi due gruppi variava tra individui con diverse condizioni dentali. Un gruppo con commensali del gruppo I, tra cui N. flavescens e P. pasteri, risultavano diminuiti nel microbiota di individui con meno denti, scarsa igiene orale e maggiore carie dentale. In alternativa, l’altro gruppo composto da commensali del gruppo II, tra cui P. histicola, V. atypica, S. salivarius e S. parasanguinis, erano specificamente predominanti nel microbiota sulle superfici della mucosa orale, incluso il dorso della lingua, e costituivano solo componenti minori del microbiota associato ai denti. Nei pazienti portatori di protesi mobili era stato registrato un aumento di Candida e specie fungine.
In un altro studio l’uso di clorexidina due volte al giorno era stato associato ad un aumento significativo della pressione arteriosa sistolica dopo 1 settimana di utilizzo in soggetti in salute e normotesi, la frequenza della detersione della lingua era un fattore predittivo.
Discussione
La cavità orale umana è un habitat importante per i microbi e una bocca sana può ospitare fino a dieci miliardi di batteri. I batteri intrappolati nelle cripte linguali potrebbero diffondersi direttamente nella circolazione attraverso il tessuto altamente vascolarizzato della lingua (18).
Diversi studi hanno suggerito un legame tra lo sviluppo del microbioma umano e l’artrite reumatoide (RA). Il Porphyromonas gingivalis sembra essere coinvolto nell’iniziazione e nella progressione dell’AR, come supportato dall’elevata presenza di parodontite (62,63). In uno studio caso-controllo, Ceccarelli F., Orrù G., Pilloni A., et al. hanno analizzato la presenza e la quantificazione di P. gingivalis in una grande coorte sana e di RA dimostrando una significativa associazione tra la percentuale di P. gingivalis sul biofilm della lingua totale e l’attività della malattia, suggerendo che lo stato microbiologico della cavità orale potrebbe svolgere un ruolo nei meccanismi patogeni dell’infiammazione. In questo studio è stato analizzato per la prima volta la percentuale di P. gingivalis sul biofilm della lingua totale; usando questa nuova misurazione, è stata identificata un’associazione tra questo valore e l’attività della malattia, fornendo nuove informazioni sull’influenza del batterio sull’AR. Gli autori hanno ipotizzato che la presenza di P. gingivalis possa stimolare cronicamente il sistema immunitario, indipendentemente dalla presenza di parodontite, portando a uno stato di infiammazione sistemica cronica (64).
Han S et al. hanno utilizzato il sistema di acquisizione delle informazioni diagnostiche DS01-B per fotografare e analizzare il rivestimento della lingua. La tecnologia di sequenziamento di nuova generazione è stata utilizzata per determinare le regioni ipervariabili V2-V4 del gene 16S rRNA per studiare il microbiota del rivestimento della lingua in pazienti con carcinoma del colon-retto e controlli sani. Prevotella, Haemophilus e Streptococcus erano dominanti nei campioni analizzati da Han et al e in confronto con le persone sane, il rivestimento spesso della lingua e l’umidità erano aumentati nei soggetti con patologie sistemiche. Il colore dominante della lingua nelle persone sane era rossastro mentre era viola nei pazienti affetti da cancro. L’abbondanza relativa di Neisseria, Haemophilus, Fusobacterium e Porphyromonas nelle persone sane era superiore rispetto a quella relativa ai pazienti con malattie sistemiche.
Lo studio ha suggerito che la diagnosi della lingua può fornire un potenziale screening e un metodo di diagnosi precoce per il cancro (65,66).
Durante l’ispezione della lingua deve essere esaminata la forma, le dimensioni, il colore e la consistenza del corpo e del mantello (67). Secondo la TCM, la sindrome del freddo è associata a lingua bianca grassa, preferenza per cibi e bevande calde, tensione addominale alleviabile con compresse di garze calde imbevute di sostanze medicamentose, urine chiare abbondanti, sensazione di freddo agli arti inferiori, feci molli, avversione al freddo e preferenza al calore. La sindrome del caldo invece è associata ad alitosi e lingua gialla densa, sensazione di caldo, preferenza per cibi e bevande fredde, sensazione di bruciore allo stomaco, stipsi, urine gialle, avversione al calore e preferenza al freddo (8, 68). Jiang B, Liang X, Chen Y, et al. hanno svolto un’ indagine per verificare l’associazione tra la diagnosi della MTC e il microbiota del rivestimento della lingua usando il sequenziamento di nuova generazione. Lo studio ha incluso 19 pazienti con gastrite con un tipico rivestimento della lingua bianco grasso o giallo denso, nonché otto volontari sani. È stato progettato un protocollo di sequenziamento rRNA 16S a doppio codice a barre abbinato a tecnologia Illumina per profilare il microbioma con rivestimento lingua, da cui sono stati ottenuti circa 3,7 milioni di tag V6 per ciascun campione. Hanno identificato 123 e 258 OTU a livello di specie che erano arricchite in pazienti con sindromi fredde/calde, rispettivamente, che rappresentano “Microbiota freddo” e “Microbiota caldo”. I risultati rivelano un’importante connessione tra il microbioma che ricopre la lingua e la diagnosi tradizionale e illustrano il potenziale del microbioma che ricopre la lingua come un nuovo biomarcatore olistico per la caratterizzazione dei sottotipi di pazienti. Lo stato del sangue, la sindrome del raffreddore o del caldo e il progresso di alcune malattie sono associati al cambiamento del microbioma sulla superficie della lingua (8).
Il microbioma orale ha anche il potenziale per fornire un’importante funzione simbiotica nella fisiologia della pressione sanguigna umana contribuendo alla generazione di ossido nitrico (NO), una molecola cardiovascolare essenziale (69). Inoltre, è noto che il NO inalato ha effetti sistemici e può proteggere dal danno da riperfusione da ischemia miocardica (70).
L’NO è prodotto dal corpo umano mediante conversione dell’arginina in NO (71). Le comunità microbiche orali integrano la produzione di NO ospite riducendo il nitrato in nitrito attraverso batteri nitrato reduttasi. Il nitrato non ridotto viene consegnato alla cavità orale nella saliva, un processo fisiologico chiamato circolazione entero-salivare del nitrato (70). Precedenti studi hanno dimostrato che l’interruzione della circolazione entero-salivare mediante l’uso di antisettici orali ha comportato un aumento della pressione arteriosa sistolica. Questi studi precedenti non includevano informazioni dettagliate sulla salute orale dei soggetti arruolati. Usando il sequenziamento e l’analisi del gene dell’rRNA 16S, Tribble GD, Angelov N, Weltman R, et al. hanno determinato che l’introduzione del collutorio antisettico alla clorexidina per 1 settimana è stata associata a cambiamenti nelle comunità batteriche della lingua e alla pressione sanguigna sistolica a riposo in soggetti in salute e normotesi sani con comportamenti igienici documentati e privi di patologie orali. La frequenza di pulizia della lingua era un fattore predittivo delle variazioni indotte dalla clorexidina nella pressione sistolica e nella composizione del microbioma della lingua. (72) L’uso di clorexidina due volte al giorno è stato associato ad un aumento significativo della pressione arteriosa sistolica dopo 1 settimana di utilizzo (73). Questi risultati supportano ulteriormente il concetto di microbioma orale simbiotico che contribuisce alla salute umana attraverso la via entero-salivare nitrato-nitrito-NO. Questi dati suggeriscono che la gestione del microbioma della lingua mediante una pulizia regolare insieme a un’adeguata assunzione di nitrati nella dieta forniscono un’opportunità per migliorare la pressione sanguigna sistolica a riposo (72,74).
La manipolazione del microbioma umano come bersaglio terapeutico per la gestione della malattia è un obbiettivo futuro per la medicina. Lo screening del microbioma della lingua di pazienti ipertesi resistenti può fornire nuove conoscenze sull’eziologia della loro ipertensione. La cavità orale è adatta per la terapia probiotica e / o prebiotica per favorire un microbiota equilibrato a causa della facilità di accesso. Ripristinare la flora orale per favorire una maggiore sintesi di NO è un paradigma completamente nuovo per biochimica e fisiologia, nonché per la medicina cardiovascolare e l’odontoiatria. Questi studi forniscono nuove intuizioni sulla relazione simbiotica tra microbioma ospite-orale (75).
Negli ultimi anni, il microbiota umano ha ricevuto molta più attenzione a causa del rapido sviluppo del sequenziamento di nuova generazione e molte ricerche hanno confermato che il microbioma è coinvolto in una serie di processi chiave del metabolismo tra cui la digestione di sostanze vegetali complesse, la produzione di elevata energia di metaboliti (ad esempio acidi grassi a catena corta), omeostasi immunitaria e protezione contro i patogeni (75,76). In generale, il cancro era considerato una malattia indotta da fattori ambientali e genetici, i microrganismi erano implicati nel 20% dei tumori maligni. Un numero crescente di prove ha dimostrato che il microbiota potrebbe influenzare la proliferazione delle cellule tumorali ed essere responsabile dei tumori spontanei in vari organi, tra cui pelle, colon, fegato, mammella e polmoni (77).
Recentemente, è stato riferito che dieta, stili di vita, fumo e probabilmente stato socioeconomico possono influenzare il profilo batterico nelle cavità orali. Inoltre, le abitudini di igiene orale possono influenzare il microbiota orale in termini sia di numero che di diversità dei microrganismi (15). I biomarcatori del microbiota del rivestimento della lingua potrebbero fornire un complemento per la diagnosi ed il monitoraggio mininvasivo di diverse malattie sistemiche ed essere un promettente contributo integrato alla medicina orale preventiva (1,19,16).
Ringraziamenti
Un ringraziamento particolare alla dott.ssa Cinzia Casu, al dr. Matteo Fanuli e alla dott.ssa Antonia Sinesi per il supporto e il contributo tecnico scientifico.